Soal Olimpiade Kimia OSN-K SMA 2017

AYO BERLATIH
Soal Olimpiade Kimia OSN-K SMA 2017
| Nama Peserta | : | |
| Tanggal Test | : | |
| Jumlah Soal | : | 30 soal |
| Waktu | : | 90 menit |
1. Di antara senyawa oksida nitrogen berikut ini, yang mengandung 36,4% massa oksigen adalah
A. NO
B. $\text{N}_2\text{O}$
C. $\text{N}_2\text{O}_3$
D. $\text{N}_2\text{O}_4$
E. $\text{N}_2\text{O}_5$
2. Untuk mengoksidasi 25 gram cuplikan $\text{FeSO}_4$ (Mr = 152), diperlukan 6,125 gram $\text{K}_2\text{Cr}_2\text{O}_7$ (Mr = 294). Pada reaksi ini, ion dikromat berubah menjadi $\text{Cr}^{3+}$, sedangkan $\text{Fe}^{2+}$ berubah menjadi $\text{Fe}^{3+}$. Kadar $\text{FeSO}_4$ dalam cuplikan di atas adalah
A. 19%
B. 38%
C. 48%
D. 76%
E. 92%
3. Volume larutan $\text{H}_3\text{P}\text{O}_4$ 0,1 M yang tepat bereaksi dengan larutan 50 mL $\text{Ba(OH)}_2$ 0,25 M adalah
A. 50 mL
B. 83,3 mL
C. 125 mL
D. 150 mL
E. 250 mL
4. Di antara konfigurasi elektron berikut yang menunjukkan unsur logam adalah
A. $1s^22s^22p^5$
B. $1s^22s^22p^63s^23p^6$
C. $1s^22s^22p^63s^23p^63d^24s^2$
D. $1s^22s^22p^63s^23p^63d^{10}4s^24p^1$
E. $1s^22s^22p^63s^23p^63d^{10}4s^24p^6$
5. Struktur Lewis berikut ini:
$\underset{\bullet \bullet }{\overset{\bullet \bullet }{\mathop{\text{O}}}}\,=\text{N}=\underset{\bullet \bullet }{\overset{\bullet \bullet }{\mathop{\text{O}}}}\,$adalah representasi dari
$\underset{\bullet \bullet }{\overset{\bullet \bullet }{\mathop{\text{O}}}}\,=\text{N}=\underset{\bullet \bullet }{\overset{\bullet \bullet }{\mathop{\text{O}}}}\,$adalah representasi dari
A. $\text{NO}_2^-$
B. $\text{NO}_2^+$
C. $\text{NO}_2$
D. $\text{NO}_2^+$ dan $\text{NO}_2^-$
E. $\text{NO}_2$, $\text{NO}_2^+$, dan $\text{NO}_2$
6. Di antara senyawa alkana berikut ini yang mempunyai interaksi van der Waals paling tinggi adalah
A. $\text{CH}_3\text{CH}_2\text{CH}_2\text{CH}_2\text{CH}_2\text{CH}_3$
B. $\text{CH}_3\text{CH}_2\text{CH}_3$
C. $\text{CH}_3\text{CH}_2\text{C}(\text{CH}_2)_4\text{CH}_3$
D. $\text{CH}_3\text{CH}_2\text{CH}_2\text{CH}_3$
E. $\text{CH}_3(\text{CH}_2)_3\text{CH}_3$
7. Jika NaBr larut dalam air, maka jenis gaya antarmolekul yang harus diputuskan adalah
A. Gaya ion-ion
B. Ikatan-Hidrogen
C. Gaya ion-dipol
D. Gaya ion-ion dan ikatan-Hidrogen
E. Dipol-dipol
8. Di antara teknik teknik berikut ini yang tidak dapat digunakan untuk menghitung $\Delta \text{H}_{\text{reaksi}$ adalah
A. Menggunakan panas pembentukan reaktan dan produk
B. Menggunakan titik leleh reaktan dan produk
C. Hukum Hess
D. Menggunakan energi ikatan reaktan dan produk
E. Kalorimetri
9. Di antara zat berikut ini
I. HCl(g)
II. Na(s)
III. HCl(aq)
IV. $\text{F}_2$(g)
yang mempunyai nilai entalpi pembentukan standard, $\Delta H_f^o=0$ adalah
I. HCl(g)
II. Na(s)
III. HCl(aq)
IV. $\text{F}_2$(g)
yang mempunyai nilai entalpi pembentukan standard, $\Delta H_f^o=0$ adalah
A. I, II, III, dan IV
B. I, II,dan IV
C. I dan II
D. II dan IV
E. Hanya II
10. Jika diketahui data energi ikatan sebagai berikut: H-H = 436 kJ/mol, $\text{O}-\text{O}$ = 142 kJ/mol, $\text{O}=\text{O}$ = 499 kJ/mol dan $\text{H}-\text{O}$ = 460 kJ/mol, maka entalpi reaksi pembentukan $\text{H}_2\text{O}_2$ adalah
A. –127
B. –209
C. –484
D. –841
E. +127
11. Di antara padatan berikut ini, yang memiliki interaksi antarmolekul hanya melalui gaya van der Waals adalah
A. $\text{CO}_2$
B. $\text{SiO}_2$
C. Cu
D. MgO
E. $\text{CH}_3\text{CH}_2\text{OH}$
12. Jika tekanan osmotik darah adalah 7,65 atm pada $37^\circ \text{C}$, maka massa (dalam gram) glukosa ($\text{C}_6\text{H}_{12}\text{O}_6$, massa molar = 180,2 g/mol) yang dibutuhkan untuk membuat 1,00 liter larutan injeksi intravenous yang tekanan osmotiknya sama dengan tekanan osmotik darah adalah
A. 3,00 g
B. 4,44 g
C. 25,4 g
D. 45,3 g
E. 56,0 g
13. Larutan aseton dibuat dengan cara melarutkan 0,50 mol aseton (Po = 345 torr) dalam 1,00 mol etanol (Po = 59,8 torr) pada $25^\circ \text{C}$. Fraksi mol aseton dalam fasa uap di atas larutan tersebut adalah
A. 0,26
B. 0,33
C. 0,50
D. 0,67
E. 0,74
14. Telah diketahui bahwa sifat koligatif suatu larutan ditentukan oleh jumlah partikel zat terlarut. Anda melakukan percobaan untuk menentukan tekanan uap jenuh dari ke 4 larutan berikut ini:
a. 0,13 m $\text{BaCl}_2$
b. 0,22 m $\text{MnSO}_4$
c. 0,24 m $\text{ZnSO}_4$
d. 0,41 m Ethylene glikol (nonelektrolit)
Berdasarkan berkurangnya tekanan uap larutan, maka urutan yang paling tepat adalah
a. 0,13 m $\text{BaCl}_2$
b. 0,22 m $\text{MnSO}_4$
c. 0,24 m $\text{ZnSO}_4$
d. 0,41 m Ethylene glikol (nonelektrolit)
Berdasarkan berkurangnya tekanan uap larutan, maka urutan yang paling tepat adalah
A. a > b > c > d
B. b > a > b > c
C. a > d > c > b
D. a > d > b > c
E. d > c > b > a
15. Untuk reaksi fasa gas $3\text{H}_2+\text{N}_2\to 2\text{N}\text{H}_3$, maka laju hilangnya $\text{H}_2$ dibandingkan terhadap laju pembentukan $\text{NH}_3$ adalah
A. Laju awalnya sama.
B. Laju hilangnya $\text{H}_2$ adalah 1/2 laju munculnya $\text{NH}_3$.
C. Laju hilangnya $\text{H}_2$ adalah 3/2 laju munculnya $\text{NH}_3$.
D. Laju hilangnya $\text{H}_2$ adalah 2/3 laju munculnya $\text{NH}_3$.
E. Laju hilangnya $\text{H}_2$ adalah 1/3 laju munculnya $\text{NH}_3$.
16. Dalam suatu ruang tertutup pada suhu tertentu terdapat 0,02 mol gas $\text{N}_2$; 0,06 mol gas $\text{H}_2$ dan 0,05 mol gas NH3 dalam keadaan setimbang. Jika ke dalam ruang dimasukkan 0,1 mol $\text{Cr}_2\text{O}_3$ sebagai katalis, maka:
A. Jumlah mol $\text{N}_2$ menjadi kurang dari 0,02
B. Jumlah mol $\text{NH}_3$ menjadi 0,06 mol
C. Kesetimbangan bergeser ke kiri
D. Harga tetapan kesetimbangan K menjadi lebih besar
E. Susunan kesetimbangan tidak berubah
17. Pada temperatur tetap, perbandingan konsentrasi gas-gas $\text{SO}_2$ : $\text{SO}_3$ dalam kesetimbangan reaksi $2\text{SO}_2(g)+\text{O}_2(g)\rightleftharpoons 2\text{SO}_3(g)$, akan berbanding lurus dengan
A. $\left[ \text{O}_2 \right]^2$
B. $\left[ \text{O}_2 \right]^{1/2}$
C. $\left[ \text{O}_2 \right]^0$
D. $\left[ \text{O}_2 \right]^{1/2}$
E. $\left[ \text{O}_2 \right]^2$
18. Jika anda mencampurkan natrium hidroksida, NaOH, dan asam asetat, $\text{CH}_3\text{CO}_2\text{H}$ dalam jumlah molar yang sama, maka spesi utama yang terdapat dalam larutan yang dihasilkan adalah (Diketahui: Ka $\text{CH}_3\text{CO}_2\text{H}=2\times 10^{-5}$)
A. $\text{Na}^+$, $\text{CH}_3\text{CO}_2^-$, $\text{OH}^-$, dan $\text{H}_2\text{O}$
B. $\text{Na}^+$, $\text{CH}_3\text{CO}_2\text{H}$, $\text{OH}^-$, dan $\text{H}_2\text{O}$
C. $\text{Na}^+$, $\text{CH}_3\text{CO}_2^-$, $\text{H}_3\text{O}^+$, dan $\text{H}_2\text{O}$
D. $\text{Na}^+$, $\text{CH}_3\text{CO}_2\text{H}$, $\text{H}_3\text{O}^+$, dan $\text{H}_2\text{O}$
E. $\text{Na}^+$, $\text{CH}_3\text{CO}_2^-$, CH3CO2H, $\text{OH}^-$, dan $\text{H}_2\text{O}$
19. Diketahui: Ksp CdS = $3,6\times 10^{-29}$; Ksp ZnS = $1,1\times 10^{-21}$. Tetapan kesetimbangan reaksi berikut:
$\text{CdS}(s)+\text{Zn}^{2+}(aq)\rightleftharpoons \text{ZnS}(s)+\text{Cd}^{2+}(aq)$ adalah
$\text{CdS}(s)+\text{Zn}^{2+}(aq)\rightleftharpoons \text{ZnS}(s)+\text{Cd}^{2+}(aq)$ adalah
A. $3,3\times 10^{-8}$
B. $2,7\times 10^4$
C. $4,2\times 10^5$
D. $2,5\times 10^{49}$
E. $3,1\times 10^7$
20. Diketahui bahwa H2S adalah asam yang lebih kuat daripada HCN.
($\text{H}_2\text{S}$: $\text{K}_{a1}=1,0\times 10^7$; $\text{K}_{a2}=1,3\times 10^{13}$; $K_a$ HCN =$6,0\times 10^{-10}$).
Tentukanlah, bila memungkinkan, ke arah manakah kesetimbangan berikut berada:
$\text{HCN}(aq)+\text{HS}(aq)\rightleftharpoons \text{CN}^-(aq)+\text{H}_2\text{S}(aq)$
($\text{H}_2\text{S}$: $\text{K}_{a1}=1,0\times 10^7$; $\text{K}_{a2}=1,3\times 10^{13}$; $K_a$ HCN =$6,0\times 10^{-10}$).
Tentukanlah, bila memungkinkan, ke arah manakah kesetimbangan berikut berada:
$\text{HCN}(aq)+\text{HS}(aq)\rightleftharpoons \text{CN}^-(aq)+\text{H}_2\text{S}(aq)$
A. Kesetimbangan mengarah ke kiri
B. Kesetimbangan mengarah ke kanan
C. Kesetimbangan sempurna setimbang ke arah kiri dan kanan
D. Dapat ditentukan bila keasaman relatif $\text{HS}^-$ diketahui
E. Tidak dapat ditentukan
21. Di antara asam asam berikut ini yang mempunyai basa konjugasi paling kuat adalah
A. Asam Askorbat, $K_a=8,0\times 10^{-5}$
B. Asam Benzoat, $K_a=6,5\times 10^{-5}$
C. Asam 3-chlorobenzoat, $K_a=1,5\times 10^{-4}$
D. Asam 2-hidroksibenzoat, $K_a=1,1\times 10^{-3}$
E. Asam Chloroasetat, $K_a=1,4\times 10^{-3}$
22. Mengenai setengah reaksi berikut ini:
$\text{ClO}_3^-+6\text{H}^++5\text{e}^-\to \frac{1}{2}\text{C}{{\text{l}}_{2}}+3\text{H}_2\text{O}$
Pernyataan yang tepat adalah
$\text{ClO}_3^-+6\text{H}^++5\text{e}^-\to \frac{1}{2}\text{C}{{\text{l}}_{2}}+3\text{H}_2\text{O}$
Pernyataan yang tepat adalah
A. Oksidasi klor
B. Oksidasi $\text{H}^+$
C. Reduksi klor
D. Reduksi $\text{H}^+$
E. Auto reduksi-oksidasi
23. Hitunglah berapa nilai potensial sel (Eosel) untuk reaksi berikut ini:
$2\text{Au}^{3+}(aq)+3\text{Zn}(s)\to 2\text{Au}(s)+3\text{Zn}^{2+}(aq)$
Jika diketahui:
$\text{Au}^{3+}(aq)+3\text{e}^-\to \text{Au}(s)\text{E}^\circ =+1,50\text{V}$
$\text{Zn}^{2+}(aq)+2\text{e}^-\to \text{Zn}(s)\text{E}^\circ =-0,76~\text{V}$
adalah
$2\text{Au}^{3+}(aq)+3\text{Zn}(s)\to 2\text{Au}(s)+3\text{Zn}^{2+}(aq)$
Jika diketahui:
$\text{Au}^{3+}(aq)+3\text{e}^-\to \text{Au}(s)\text{E}^\circ =+1,50\text{V}$
$\text{Zn}^{2+}(aq)+2\text{e}^-\to \text{Zn}(s)\text{E}^\circ =-0,76~\text{V}$
adalah
A. +0,74 V
B. +1,48 V
C. +2,26 V
D. –1,48 V
E. –2,26 V
24. Di antara kelompok senyawa berikut yang termasuk aldehida, asam, dan alkohol (tidak perlu berurutan) adalah
A. $\text{HC}\text{O}_2\text{H}$, $\text{CH}_3\text{CO}_2\text{CH}_3$, $\text{CH}_3\text{CH}_2\text{OH}$
B. $\text{H}_2\text{CO}$, $\text{CH}_3\text{CH}_2\text{OH}$, $\text{CH}_3\text{CO}_2\text{CH}_3$
C. $\text{CH}_3\text{CO}_2\text{H}$, $\text{CH}_3\text{OH}$, $\text{CH}_3\text{CH}_2\text{OCH}_3$
D. $\text{H}_2\text{CO}$, $\text{CH}_3\text{CO}_2\text{H}$, $\text{CH}_3\text{CHO}$
E. $\text{H}_2\text{CO}$, $\text{CH}_3\text{CO}_2\text{H}$, $\text{CH}_3\text{CH}_2\text{OH}$
25. Di antara kelima senyawa organik di bawah ini yang paling benar tatanamanya secara IUPAC adalah
A. 2-bromo-4-hidroksi-4-pentena
B. 2-metil-1-pentena-4-ol
C. 2-kloro-1,3-sikloheksadiena
D. 2-metil-2-heksena-4-ol
E. 5-metil,-sikloheksena-1-ol
26. Urutan keasaman yang paling tepat untuk senyawa-senyawa berikut
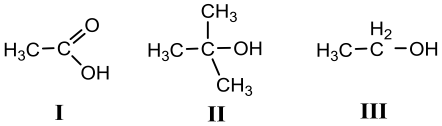
adalah

adalah
A. I > III > II
B. I > II > III
C. II > I > III
D. II > III > I
E. III > I > II
27. Semua senyawa berikut ini mempunyai rumus molekul $\text{C}_4\text{H}_{10}\text{O}$ dan merupakan isomer. Yang bukan isomer $\text{C}_4\text{H}_{10}\text{O}$ adalah
A. Butanon
B. Di etil eter
C. Metil propil eter
D. 1-butanol
E. 2-metil-2-propanol
28. Reaksi kesetimbangan berikut ini:
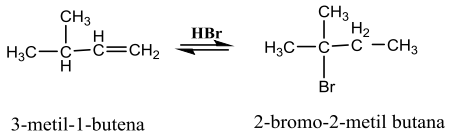
Reaksi tersebut adalah:

Reaksi tersebut adalah:
A. Reaksi substitusi
B. Reaksi adisi Markovnikov
C. Reaksi adisi anti Markovnikov
D. Reaksi eliminasi
E. Reaksi Radikal
29. Jika senyawa sikloheksena direaksikan dengan ($\text{Br}_2$, $\text{h}\upsilon $) sebagaimana skema berikut:
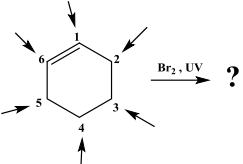
maka bromida dapat masuk pada posisi nomor

maka bromida dapat masuk pada posisi nomor
A. Pada nomor 1 dan 6
B. Pada nomor 2 dan 3
C. Pada nomor 2 atau 5
D. Pada nomor 3 dan 4
E. Hanya 4
30. Senyawa yang disebut dengan karbonium tersier di bawah ini adalah
A. $(CH_3)_2CH\overset{\oplus }{\mathop{C}}\,H_2$
B. $(CH_3)\overset{\oplus }{\mathop{C}}\,H(CH_3)$
C. $\oplus CH_3$
D. $(CH_3)_2\overset{\oplus }{\mathop{C}}\,(C_2H_5)$
E. $C_2H_5^{\oplus }$
This quiz has been created by Ayo Berlatih
